به نقل از دیجیکالا:
بدون تلفن همراه، لپتاپ یا چراغ قوه، بدون ماشین برقی یا جاروبرقی رباتی، بدون ساعت، ماشین حساب جیبی، یا رادیوی ترانزیستوری! زندگی بدون باتری سفری به گذشته است، جایی که در یک یا دو قرن قبل تقریباً تنها راه برای تولید انرژی، استفاده از زور فیزیکی یا بخار بود. به طور کلی باتریها منابع تغذیهی مفید، راحت و به کوچکی یک بند انگشت یا به بزرگی صندوق عقب یک ماشین هستند که در هر زمان و هر کجا که به آن نیاز داشته باشیم، انرژی الکتریکی مطمئن و ثابتی را به ما هدیه میکنند. اگرچه سالانه میلیاردها دلار صرف ساخت این نوع از منابع الکتریکی میشود و قابل کتمان نیست که تأثیرات زیست محیطی زیادی هم دارند، اما ما انسانها نمیتوانیم زندگی مدرن خود را بدون آنها پیش ببریم.
در نگاه اول به باتری ممکن است این طور فکر کنید که چنین کالایی واقعا خستهکننده است و هیچ جذابی برای کندوکاو ندارد! اما در این مقاله به شما نشان خواهیم داد که علارقم ظاهر سادهی باتری، این استوانهی قلمی دنیای هیجانانگیز را در خود دارد و میتواند در لحظه به نیروگاه کوچک شما تبدیل شود! اما چطور؟
باتری دقیقا چیست؟
قطعات اصلی یک باتری چیست؟
باتریها چطور جریان الکتریکی را جاری میکنند؟
پای قورباغه مرده و نقش آن در تاریخچهی ساخت باتری
انرژی باتری از کجا سرچشمه میگیرد؟ (نگاهی دقیقتر به باتریها)
مروری کوتاه بر انواع باتری
باتری دقیقا چیست؟

به زبان ساده باتری یک بستهی انرژی شیمیایی مستقل است که میتواند مقدار محدودی انرژی الکتریکی در هر کجا که نیاز باشد، تولید کند. برخلاف الکتریسیته معمولی که از طریق سیمهای ویژه از یک نیروگاه به خانه شما میآید، یک باتری به آرامی مواد شیمیایی بستهبندی شده در درون خود را به انرژی الکتریکی تبدیل میکند.
قطعات اصلی یک باتری چیست؟
قدرت اصلی باتری در داخل آن و در جایی به نام سلول است. سلول یک باتری از سه بخش اصلی تشکیل شده است، که شامل دو الکترود (پایانههای الکتریکی) و یک ماده شیمیایی به نام الکترولیت در بین آنها میشود. به منظور راحتی و ایمنی ما، تمامی این بخشها معمولاً در داخل یک قاب بیرونی فلزی یا پلاستیکی جا داده میشود. در کنار این سه یخش اصلی، دو پایانهی الکتریکی مفید دیگر هم وجود دارد که با علامتهای + (قطب مثبت) و – (قطب منفی) مشخص شده است و در قسمت بیرونی به الکترودهایی که در داخل باتری هستند، متصلاند. تفاوت بین باتری و سلول در این است که از ترکیب دو یا چند سلول میتوان یک باتری ساخت که توان آن بیش از یک تک سلول است.
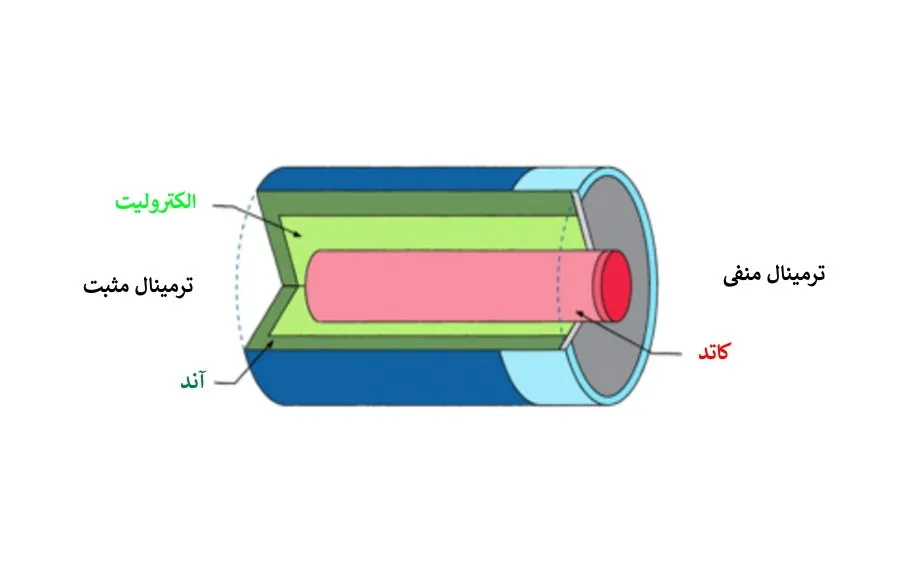
قطعات اصلی یک باتری
زمانی که دو الکترود یک باتری را به یک مدار متصل میکنید، به عنوان مثال زمانی که باتری قلمی را در چراغ قوه قرار میدهید، الکترولیت درون سلول باتری شروع به وزوز کردن میکند و کم کم مواد شیمیایی داخل آن به مواد دیگری تبدیل میشوند. به عبارتی یونهایی (اتمهایی با الکترونهای بسیار کم یا زیاد) که از مواد موجود در الکترودها تشکیل شدهاند در واکنشهای شیمیایی با الکترولیت شرکت میکنند. در همان زمان، الکترونهای آزاد حاصل از تشکیل یونها از طریق مدار بیرونی از یک پایانه به پایانهی دیگر حرکت میکنند و هر چیزی که باتری به آن متصل است را تغذیه میکنند.
چرا بعد از مدتی باتری قلمی دیگر کار نمیکند؟
همانطور که در بخش قبلی کاملا توضیح داده شد، الکترونهای آزاد شده میتوانند از سر قطب منفی در مدار شارش و انرژی الکتریکی مورد نیاز مدار را تامین کنند. حال اگر این روند آنقدر ادامه پیدا کند تا مادهی الکترولیت داخل باتری به طور کامل به مادهی دیگری تبدیل شود، عملا باتری تخلیه شده یا به عبارتی تمام شده است.
باتریها چطور جریان الکتریکی را جاری میکنند؟
الکترودهای یک باتری همیشه از دو مادهی متفاوت ساخته شده میشوند به این معنی که هرگز هر دو از یک فلز ساخته نمیشوند. از آنجایی که دو فلز به کار رفته شده در الکترودهای باتری متفاوت است، رسانایی الکتریکی این دو ماده هم با یکدیگر متفاوت میشود. در چنین حالتی یکی از الکترودها (فلزهای پایانهی باتری) تمایل به جذب الکترونها دارد و دیگری به راحتی الکترونها را عبور میدهد. همین مساله هم کلید توضیح در مورد سازوکار باتریها است. طبیعی است که اگر هر دو الکترود از یک ماده ساخته میشدند، عبور الکترونی اتفاق نمیافتاد و به دنبال آن جریانی هم در کار نبود.
پای قورباغه مرده و نقش آن در تاریخچهی ساخت باتری
شاید برای شما هم جالب باشد اگر بدانید که اولین بار شخصی به نام «لوئیچی گالوانی» فهمید که میتواند به کمک پای قورباغه، الکتریسیته تولید کرد! این دانشمند با فرو کردن دو فلز (دو الکترود) مختلف در پای یک قورباغه مرده توانست جریان الکتریسیته را تولید کند. او نام این جریان را «الکتریسیته حیوانات» گذاشت. پس از آن فرد دیگری به نام «الکساندر ولتا» متوجه شد، که گالوانی از دو فلز متفاوت در این آزمایش استفاده کرده است و طی آن بدن قورباغه به عنوان الکترولیت عمل کرده است. در نتیجه چیزی که حاصبل شده بود یک باتری قورباغهای بود. با گذشت زمان مشخص شد که هیچ چیز خاص و عجیبی در بدن قورباغه وجود ندارد و یک ماده شیمیایی مناسب یا حتی یک عدد لیمو میتواند به عنوان ماده الکترولیت استفاده شود.
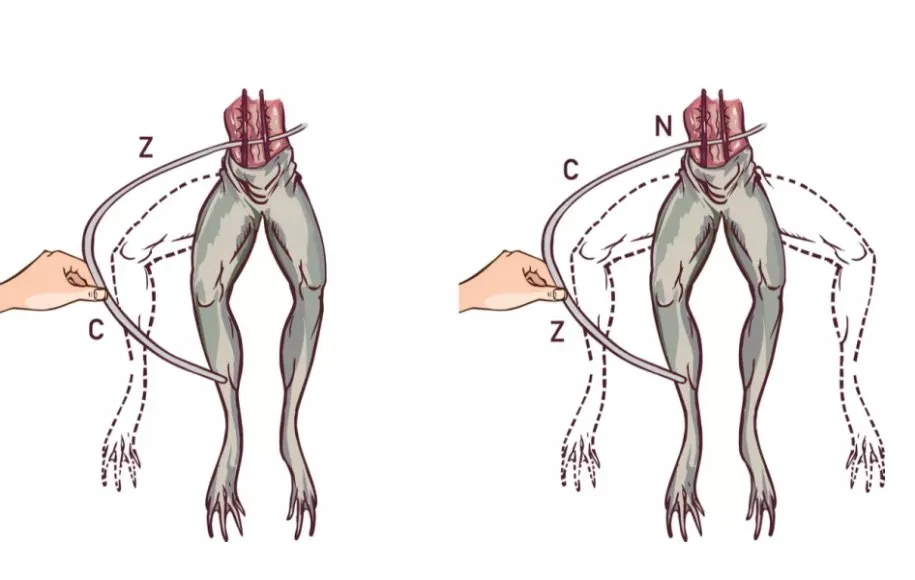
بدن قورباغه به عنوان الکترولیت
کندوکاوی بیشتر در دنیای الکترودها
همانطور که احتمالا ممکن است آشنایی داشته باشید، عناصر شیمیایی مختلف از نظر توانایی جذب الکترونها به سمت خود با یکدیگر متفاوت هستند که این ویژگی با نام الکترونگاتیوی معرفی میشود. الکترونگاتیوی پارامتری برای سنجش الکترون خواهی عناصر شیمیایی است. در واقع هرچه یک عنصر الکترونگاتیوتر باشد، تمایل آن برای جذب الکترون بیشتر است. به طور کلی با اتصال دو فلز مختلف در یک الکترولیت، و قرار دادن آن در یک مدار الکتریکی بیرونی میتوان شاهد برقراری جریان الکتریکی یا همان شارش الکترونها بود. در همین راستا یکی از فلزات که الکترونگاتیوتر است، تمایل به جذب الکترونهای فلز بیشتر از دیگری دارد. طبیعی است که اگر دو فلز، از مواد یکسانی ساخته شده بودند، هیچگونه جریانی در مدار برقرار نمیشد.
اولین بار شخصی به نام «لوئیچی گالوانی» فهمید که میتواند به کمک پای قورباغه، الکتریسیته تولید کرد! این دانشمند با فرو کردن دو فلز (دو الکترود) مختلف در پای یک قورباغه مرده توانست جریان الکتریسیته را تولید کند. او نام این جریان را «الکتریسیته حیوانات» گذاشت.
انرژی باتری از کجا سرچشمه میگیرد؟ (نگاهی دقیقتر به باتریها)
هدف ما از این بخش این است که نگاه دقیقتری به باتری داشته باشیم و بفهمیم که انرژی آن از کجا میآید! به منظور درک این موضوع یک مدار ساده شامل یک لامپ کوچک، سیم رسانا و باتری را در نظر بگیرید. یکی از پایههای لامپ را به الکترود یا قطب + باتری و سر دیگر آن را به الکترود یا قطب منفی باتری وصل میکنیم. همانطور که در شکل مشخص است، الکترودهای مثبت و منفی توسط ماده الکترولیت از یکدیگر جدا شدهاند. الکترولیت میتواند مایع و یا جامد باشد. لازم به ذکر است که در باتریهای معمولی یا همان قلمی، مادهی الکترولیت، غالباً پودری خشک است.
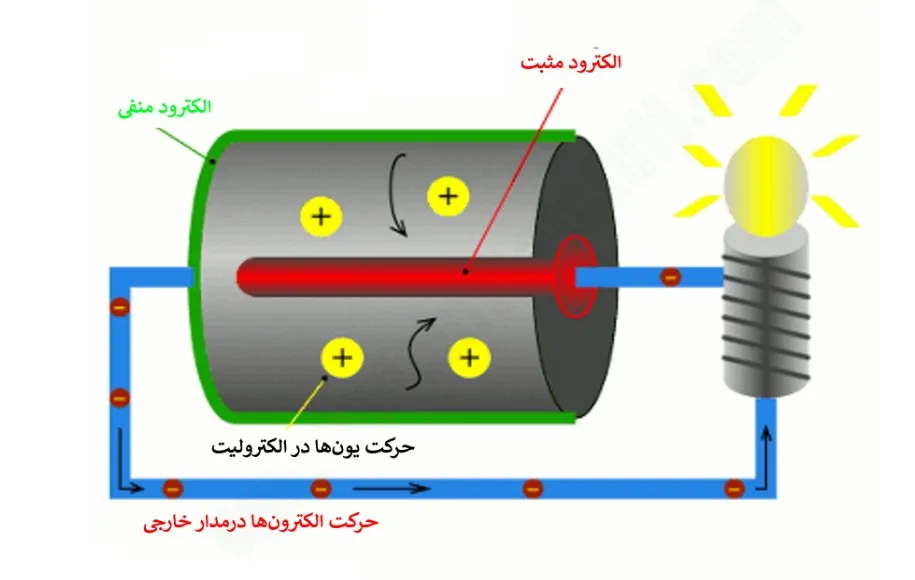
الکترودهای مثبت و منفی توسط ماده الکترولیت از یکدیگر جدا شدهاند
هنگامی که باتری را به یک لامپ وصل و آن را روشن میکنید، واکنشهای شیمیایی درون ماده الکترولیت و الکترودها شروع میشود. طی این واکنشها یونهای مثبت و الکترونها تشکیل میشوند و طی آن الکترونهای تشکیل شده به سمت الکترود منفی حرکت میکنند. همچنین یونهای مثبت درون الکترولیت جابهجا شده و الکترونها از طریق الکترود منفی و سیم رسانا در مدار شارش پیدا میکنند. سپس الکترونهای شارش یافته در مدار، به الکترود مثبت وارد میشوند و از این طریق میتوانند جذب یونهای مثبت و موجود در الکترولیت شوند. بدین ترتیب الکترون و یونها توسط واکنشهای شیمیایی که در الکترولیت رخ میدهد در جریان هستند.
از آنجایی که در ماده الکترولیت واکنشهای شیمیایی به شکل دائمی و پشت سر هم رخ میدهند، در پایان تمامی مادهی الکترولیت به مادهی دیگری تبدیل میشود و دیگر توانایی انجام تشکیل یونهای مورد نیاز و جدید را ندارد. بدین ترتیب به مرور زمان، ولتاژ باتری افت پیدا میکند. درواقع اختلاف پتانسیل عامل حرکت بار الکتریکی است و با کاهش ولتاژ، الکترونهای مورد نیاز جهت تامین انرژی لوازم الکتریکیای مانند لامپ در مدار شارش پیدا نمیکنند. لازم به تاکید است که جریان الکتریکی در سازکار پیش رو از قطب منفی باتری به سمت قطب مثبت آن است اما در فیزیک الکتریسیته و مهندسی برق، جهت جریان را به صورت قراردادی از قطب مثبت به قطب منفی در نظر میگیرند.
چرا الکترونها برای حرکت به سمت قطب مثبت، از الکترولیت عبور نمیکنند؟
در حالت کلی الکترولیتها از نظر الکتریکی همانند عایقها هستند و مقاومت بالایی دارند. در نتیجه همانند سدی در برابر عبور الکترونها عمل میکنند و الکترونها به ناچار باید از مسیر بیرونی (سیم رسانا) جریان پیدا کنند.
- باتریهای لیتیوم-یونی چطور کار میکنند و آیا واقعا خطر انفجار دارند؟
- حقایقی درباره کارکرد ماشین حساب که شاید نمیدانستید!
مروری کوتاه بر انواع باتری

باتری ها از نظر اشکال، اندازهها، ولتاژها و ظرفیتهای مختلف (مقدار شارژ یا انرژی ذخیره شده در آن) متفاوت هستند. در همین راستا اگرچه میتوان انواع باتریها را با انواع الکترولیتها و الکترودهای شیمیایی مختلف ساخت، اما این دسته از محصولات معمولا در دو نوع اصلی تقسیمبندی میشوند که شامل باتریهای اولیه (یکبار مصرف) و ثانویه میشود. منظور از باتریهای اولیه، باتریهایی هستند که تنها یک بار قابل استفاده هستند و پس از اتمام ظرفیت، کاربردی ندارند. در حالی که باتریهای ثانویه کالاهایی هستند که پس از اتمام ظرفیت، قابلیت شارژ دوباره دارند. در واقع با قرار دادن آنها در خلاف جهت معمول در مدار (یعنی جریان عکس) میتوان آنها را دوباره شارژ کرد.
انواع باتریهای اولیه یا یکبار مصرف
اگرچه باتریهای یکبار مصرف دوستدار محیط زیست نیستند، اما یک مزیت عمده دارند و آن این است که معمولاً انرژی بسیار بیشتری را ذخیره میکنند و به طور قابل توجهی بیشتر از دیگر محصولات عمر میکنند. در همین راستا جالب است بدانید که سه نوع اصلی از باتریهای اولیه در بازار وجود دارد که به نامهای کربن-روی، قلیایی و لیتیومی معروف هستند. مادهی الکترولیت این دسته از محصولات جامد است، به همین دلیل هم اغلب به آنها سلولهای خشک گفته میشود.
- باتری روی ـ کربن (Zinc – Carbon): ارزانترین و معمولیترین باتریهایی که هر روزه برای لوازمی مانند چراغ قوه یا موس استفاده میکنید جزو این دسته از کالا ها هستند. این نوع باتریها گرچه ارزان قیمت و برای کاربردهای معمولی مناسباند، اما ظرفیت و عمر زیادی ندارند و نیاز به تعویض زود به زود دارند.
- باتری قلیایی (Alkaline): باتریهای قلیایی تقریباً شبیه به باتریهای کربن روی هستند، اما ظرفیت بیشتری دارند، انرژی بیشتری ذخیره میکنند و عمر طولانیتری دارند، به همین دلیل هم گرانتر هستند. جالب است بدانید الکترود مثبت در این نوع باتریها از جنس منگنز اکسید (Manganese (IV) Oxide) و الکترود منفی از جنس روی (Zinc) ساخته شده است. الکترولیت نیز محلول قلیایی غلیط پتاسیوم هیدروکسید (Potassium Hydroxide) است.
- باتریهای سکهای: بسیاری از باتریهای سکهای در لوازمی مانند ساعتهای کوارتز و سمعکها استفاده میشوند. جالب است بدانید که الکترودهای این نوع باتریها مشابه باتریهای قلیایی است با این تفاوت که ماده الکترولیت آنها به جز مواد قلیایی، الکترولیتهای دیگر نیز میتواند باشد.
انواع باتریهای ثانویه (قابل شارژ)
در ادامه به معرفی و بررسی برخی باتریهای قابل شارژ پر مصرف در جهان میپردازیم.
- باتری سرب-اسید (Lead-Acid): باتریهای سرب – اسید که به باتریهای ماشین در بازار معروف هستند، از شش سلول دو ولتی تشکیل شدهاند که در مجموع، ولتاژ دو سر این نوع باتریها ۱۲ ولت است. الکترود منفی در این نوع باتریها از جنس سرب متخلخل و الکترود مثبت آن از اکسید سرب است. مادهی الکترولیت آن هم اسید سولفوریک است.
- نیکل کادمیوم (Nickel-Cadmium): باتریهای نیکل کادمیوم، به دلیل قیمت پایینی که دارند به طور عمده جایگزین باتریهای یکبار مصرف ۱.۵ ولتی همان قلمیها در استفادههای روزمرهی مردم شدهاند. لازم به ذکر است باتریهای نیکل کادمیوم دارای اثری موسوم به اثر حافظه (memory effect) در شارژ و دشارژ هستند. به این معنی که برای استفادهی بیشتر از این نوع باتریها، ابتدا باید به طور کامل تخلیه (دشاٰرژ) شوند و سپس آنها را دوباره شارژ کرد.
- نیکل-هیدرید فلز (NiMH): باتریهای نیکل هیدرید مشابه با مشابه باتریهای نیکل کادمیوم عمل میکنند، اما کمتر از اثر حافظه رنج میبرند.
- باتری لیتیوم یون (Lithium Ion): باتریهای لیتیوم یونی سریعترین نوع باتریهای قابل شارژ هستند. که احتمالاً با آنها در تلفن همراه، پخش کنندهای موزیک و لپ تاپ مواجه شدهاید. در مقام مقایسه، باتریهای لیتیوم یون ظرفیتی دوبرابر نسبت به باتریهای قابل شارژ نیکل کادمیوم در ابعاد مشابه دارند.
منبع: explain that stuff





